| 工程中心杨祥良教授、甘璐教授团队在改善胰腺癌化疗疗效方面取得重要进展 |
| 发布时间:2024-11-07
点击次数: |
|
2024年11月4日,《自然-纳米技术》(Nature Nanotechnology)在线发表华中科技大学生命科学与技术学院、国家纳米药物工程技术研究中心杨祥良教授、甘璐教授团队与东南大学附属中大医院滕皋军院士合作完成的研究论文“Targeted intervention in nerve–cancer crosstalk enhances pancreatic cancer chemotherapy”。 胰腺癌是恶性程度极高的肿瘤,化疗是其重要的治疗手段,但疗效有限,肿瘤复杂的微环境是影响其疗效的主要原因之一。最近研究发现,多种实体瘤,包括胰腺肿瘤存在高度神经支配,与肿瘤的发生、发展及不良预后密切相关。肿瘤与神经的相互作用为肿瘤生长提供了有利的微环境,肿瘤细胞分泌的神经营养因子如神经生长因子(NGF)等,能招募神经浸润并促进其生长;而神经也会释放神经递质如去甲肾上腺素等,刺激肿瘤细胞的增殖和侵袭,促进血管新生,并诱导免疫抑制。值得注意的是,化疗药物被发现能增加肿瘤内的神经浸润,诱导化疗抵抗。因此,有效干预肿瘤与神经的相互作用可能是提高胰腺癌化疗疗效的潜在策略。 该研究以来源于益生菌大肠杆菌Nissle 1917的外膜囊泡(OMVs)为载体,在其表面修饰神经结合肽NP41,负载原肌球蛋白受体激酶(Trk)抑制剂拉罗替尼(Lar)。此载药OMVs(Lar@NP-OMV)靶向肿瘤内神经,阻断NGF/Trk信号通路,有效干预神经功能,抑制神经的增殖、轴突生长及神经递质的分泌;此外,OMVs还能将M2型肿瘤相关巨噬细胞(TAMs)逆极化为M1型,释放细胞因子如TNF,进一步诱导神经损伤,通过减弱去甲肾上腺素/β-肾上腺素受体信号,有效抑制神经诱导的肿瘤细胞增殖、迁移和血管生成,并显著改善肿瘤免疫微环境。在多种荷胰腺肿瘤动物模型中证实Lar@NP-OMVs能有效抑制肿瘤生长和转移,并能减弱化疗药物吉西他滨促神经浸润和轴突生长作用,显著改善化疗疗效。该研究为改善胰腺癌化疗效果提供了新的思路。 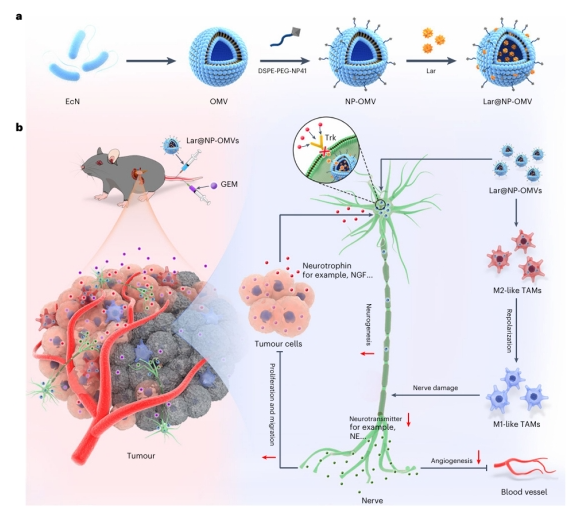
华中科技大学生命科学与技术学院博士生秦佳琪、刘婧杰为该论文共同第一作者,东南大学附属中大医院居胜红教授、博士生赵奔以及华中科技大学同济医学院附属协和医院勾善淼教授等参与了该工作。该研究得到了国家重点研发计划和国家自然科学基金等项目的资助。 原文链接:https://www.nature.com/articles/s41565-024-01803-1
|
|
