| 杨祥良教授、赵彦兵教授在肝癌综合介入治疗方面取得新突破 |
| 发布时间:2020-07-29
点击次数: |
|
7月22日,华中科技大学生命学院暨国家纳米药物工程研究中心杨祥良教授、赵彦兵教授团队在设计构建新型肝癌综合介入治疗用纳米材料方面取得新突破:在化学与纳米材料领域权威期刊Nano Today(IF=16.907)上发表了论文题目为“射频响应型双价金纳米簇增强肿瘤消融和动脉栓塞的协同治疗(Radiofrequency-Responsive Dual-Valent Gold Nanoclusters for Enhancing Synerg istic Therapy of Tumor Ablation and Artery Embolization)”的研究成果
血管栓塞术(Transcatheter Artery Embolization, TAE)和以射频消融(Radio-Frequency Ablation, RFA)为代表的肿瘤消融术,是不可切除的中晚期肝癌的首选方法。通过互补性协同方式,多种TAE-RFA联合疗法已在肝癌综合治疗中得到广泛应用。例如,RFA通过高频交变电流使组织内多种离子发生振荡,并发热导致肿瘤发生消融坏死。但对于血供丰富的肝癌,特别是离电极针较远的肿瘤组织,通过血流的热量耗散作用,射频热沉积效率极低,温度梯度迅速降到50 oC(肿瘤发生消融的临界温度)以下。临床上通过TAE封闭血供,可在一定程度上提高肿瘤组织的“热沉积效应”,改善肿瘤的热分布。然而,如何进一步增强TAE与RFA的协同作用,提高两者的治疗效果,在肝癌综合介入治疗中仍是一个巨大的挑战。 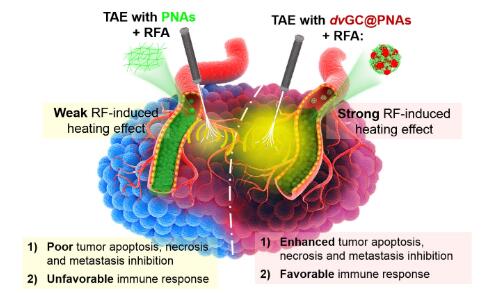
为此,本研究合成了具有双化合价态(Au(I)离子和Au(0)原子)的金纳米簇dvGCs,并采用温敏聚合物PNA对其进行表面修饰,得到具有射频热响应的复合纳米凝胶血管栓塞剂(dvGC@PNAs)。通过温敏溶胶-凝胶相变,dvGC@PNAs很好地解决了血管栓塞材料面临的“流动-栓塞困境”:即,在超液化导管通过性和“铸型”化全级血管栓塞性之间存在的矛盾。而且,dvGCs良好的射频热效应,结合TAE的血管封闭效应,能有效增强瘤周及富血供区域的热沉积效率,提高肿瘤消融和血管栓塞的协同作用。同时,研究还发现,dvGC@PNAs显著改善栓塞后的缺氧微环境,并可激活肿瘤免疫反应,高效杀灭残存肝癌细胞,能有效防止肿瘤复发和转移。该研究为设计发展多功能纳米材料用于增强肝癌综合介入治疗的疗效提供了新思路。 华中科技大学生命学院杨祥良教授、赵彦兵教授、附属协和医院郑传胜教授为本论文的共同通讯作者,华中科技大学生命学院李玲博士、彭晓乐硕士和附属协和医院郭小朋博士为本论文的共同第一作者,华中科技大学为第一作者单位。研究工作得到国家重点研发计划和国家自然科学基金项目的资助。
|
|
